Qualität+Innovation · 01. Juni 2022
Wie berichtet, hat die EU Ende des vergangenen Jahres Übergangsfristen für die seit dem 26.05.2022 geltende Verordnung über In-vitro-Diagnostika (IVDR) verlängert. So wurde verhindert, dass In-vitro-Diagnostika (IVD) vom Markt genommen werden müssen, bei denen die „Zulassung“ durch sogenannte Benannte Stellen stockt (vgl. Presseerklärung Europäische Kommission vom 20.12.2021). Ein problematischer Nebeneffekt dieser Fristverlängerung ist, dass EU-weit marktgängige...
Recht+Vergütung · 15. Oktober 2021
Die Vorbereitungen bis zum vollständigen Inkrafttreten der EU-Verordnung über In-vitro-Diagnostica (IVDR) zum 26. Mai 2022 sind erheblich in Verzug geraten. Vor allem fehlt es an "Benannten Stellen" zur Zertifizierung von IVD nach den neuen Regularien. Mit einem Vorschlag zur Fristverlängerung reagiert die Europäische Kommission jetzt auf die Warnungen von Verbänden und Institutionen im Bereich der medizinischen Diagnostik. Demnach soll die IVDR zwar im Mai des kommenden Jahres planmäßig...
Digitalisierung · 17. Juni 2019
Das BMG hatte zur „Meinungsbildung“ über den Referentenentwurf für ein Digitale Versorgung-Gesetz eingeladen und erhielt am Montag das erhoffte umfangreiche Feedback von Verbänden und Institutionen. Nahezu einmütig wird der Gesetzentwurf als Meilenstein der Digitalisierung im Gesundheitswesen begrüßt. Intensiv diskutiert wurden v. a. diese Punkte: Welche Gesundheits-Apps sollen zur Verschreibung durch Ärzte zugelassen werden? Aus Laborsicht besonders interessant: Welche...
31. Januar 2019
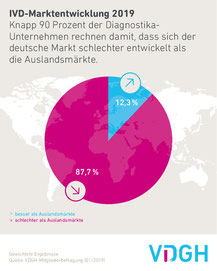
Der Verband der Diagnostica-Industrie (VDGH) bilanziert im Ergebnis einer Branchenumfrage für 2018 Umsatzrückgänge von 2,2% auf dem deutschen IVD-Markt. Bei den Schnelltesten gingen die Umsätze um 5% zurück. Gründe hierfür sieht der VDGH im Preisdruck und in technologischen Umbrüchen, vor allem im Bereich der Diabetika. Die Aussichten für Deutschland beurteilen die Hersteller skeptischer als für ausländische Märkte (s. Grafik).